موازنه در شیمی
در مقاله قبلی در مورد نماد شیمیایی و معادله ی شیمیایی واکنش ها توضیحاتی ارائه شد.
در این مقاله به بررسی قانون پایستگی ماده یا جرم خواهیم پرداخت و نحوه ی موازنه کردن یک معادله ی شیمیایی ارائه خواهد شد...
(مشابه این قانون پیوستگی انرژِی نیز چنین عنوان می شود که انرژی از بین نمی رود و به وجود نمی آید، بلکه از صورتی به صورت دیگر تبدیل می شود.) پس ...
پس ...
به طور مثال اگر از اتم x در سمت واکنش دهنده ها 5عدد وجود دارد، حتماً در طرف دیگر واکنش در بخشفراورده نیز از اتم x تعداد 5 عدد وجود داشته باشد.
مثال زیر، معادله ی واکنش شیمیایی سوختن گاز متان است:
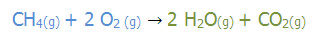
به ترتیب برای تعداد هر اتم، در سمت راست و چپ واکنش (واکنش دهنده ها و فراورده ) باید بررسی شود. اتم کربن در هر دو طرف معادله یک عدد می باشد. با قرار دادن عدد 2 در پشت آب ( H2O) خواهیم دید که تعداد اتم های هیدورژن در هر دو طرف معادله برابر 4 اتم می باشد. تعداد اتم های اکسیژن در سمت راست 4 اتم می باشد پس با قرار دادن ضریب دو برایاکسیژن (O2)تعداد اتم های اکسیژن در دو طرف معادله 4 و برابر می باشد.
به هنگام موازنه کردن این معادله ی شیمیایی، زیروند (اندیس) های موجود در فرمول شیمیایی واکنش دهنده ها و فرآورده ها تغییر نکرد، بلکه ضرایب غیر کسری مناسبی انتخاب و پیش از فرمول شیمیایی واکنش دهنده ها و فراورده ها قرار گرفت. این
طبق قرارداد؛
ضرایب نهایی موجود در یک معادله ی موازنه شده بایستی کوچک ترین عدد صحیح (غیر کسری) ممکن باشد.
به مثال های زیر توجه کنید:
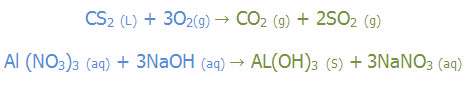
موازنه کردن به روش والسی
رایج ترین روش برای موازنه کردن یک معادله شمیایی، روش وارسی نام دارد. در این روش
برای موازنه کردن معادله ی شیمیایی واکنش به روش وارسی اقدامات زیر الزامی است:
- 1- تعداد اتم های هر یک از عنصرها در دو طرف واکنش شمرده شود.
- 2- انتخاب عنصر مرجع:
- یک ترکیب از واکنش دهنده ها یا فراورده یا بیش ترین تعداد اتم از عنصری غیر از هیدروژن و اکسیژن انتخاب شود و برای آن اتم موازنه برای دو طرف معادله انجام شود.
- 3- تعداد اتم های اکسیژن موازنه گردد.
- 4- در پایان تعداد اتم های هیدروژن نیز موازنه گردد.
این عنصر باید به ترتیب اولویت شرایط زیر را داشته باشد:
- 1- در هر سمت واکنش فقط در ساختار یک ماده حضور داشته باشد.
- 2- تا حد امکان نباید در ساختار یک ماده ی تک عنصری شرکت داشته باشد، مگر این که هیچ عنصری شرط اول را نداشته باشد.
- 3- بین دو عنصر که هر دو شرایط 1 و 2 را دارند موازنه را از ساختار ترکیبی آغاز می کنیم که نوع و تعداد اتم های بیشتر باشد.
- 4- اگر بین دو عنصر، شرایط بالا یکسان بود، به زیر وند ها دقت می کنیم و ابتدا عنصری را موازنه می کنیم که زیر وند بزرگتری دارد.
نکته: اگر در موازنه با ضریب کسری مواجه شدیم، کل طرفین را باید در کوچکترین مضرب مشترک کسرها ضرب کنیم تا ضریب های کسری از بین بروند.
به مثال های زیر توجه کنید:
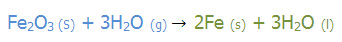
عنصر آغازگر Fe است.
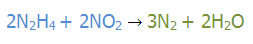
عنصر آغاز گر H است.
در مقالات بعدی در مورد انواع واکنش های شیمیایی توضیحاتی ارائه خواهد شد
فاطمه بخت اور

